学び直す糖尿病の酸塩基平衡:ケトアシドーシスを理解する
はじめに
酸塩基平衡は必須の知識でありながら、かなり難しく考えられているように思われる。若い医師たちを見ていると、血液ガス解釈のテクニックを習得することだけに満足してしまっていたり、診断や治療のアルゴリズムに盲目的に従うだけで、患者を背景とした病態に思いが至っていない状況も多く経験する。例えば、糖尿病におけるケトン体の理解についても同様である。ケトン体はどのような時には善人で、どうしたら悪人になるのか?そのような医学部でしっかり学び、臨床経験を積んだ医師ならば当然分かるべきことが分かっていないのが実情のようである。
この原因に思いを至らせるに、「木を見て森を見ない」現在の医学教育に問題があるように思われる。血液ガスの解析はできても、それが今そこにいる患者の病態に、どのような影響を与えているかを理解できていないのである。
本稿では酸塩基平衡の基本・基礎医学(生化学・生理学)的考察に立ち返り、なるべく臨床に直結するように解説していきたい。
1.酸とは何か?アニオン・ギャップとは何か?
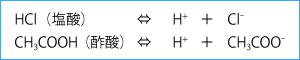
高校の化学基礎で習うブレンステッド・ローリーの定義によれば、酸とはH+(プロトン)を供与するもの、塩基(アルカリ)とはそれを受け取るものと定義される。実際、塩酸や酢酸などの酸は電離すると以下のようにH+を分離することから、H+を与えるもの、つまり、酸と定義できる。
このように、一般に酸を陽イオンであるプロトンと陰イオンA‐の化合物として表現すると以下の①のようになる。
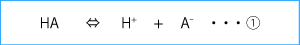
この式から分かるように、酸が発生するとプロトンのパートナーとなる陰イオン(A‐)が同時に生まれることを意味する。ここで重要なことは、ブレンステッド・ローリーの定義によればA‐は、H+を受容するという点で塩基(アルカリ)であるということである。実際、A‐の多くが代謝を受けると重炭酸イオンなどアルカリを産生する。
一方、プロトンはpH=7.4、つまり、[H+]=10‐7.4=10‐7×0.4=40×10‐9=40nmol/Lという濃度に厳密に管理され、酸発生によりH+が増加すると、すぐに細胞外液に豊富に存在する重炭酸イオン(HCO3‐)により緩衝され、その増加はわずかに留まる(②)。
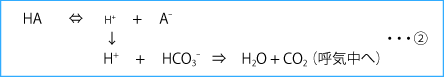
ここでもし、A‐がすぐに代謝や排泄を受けずに細胞外液(血液)中にしばらく留まれば、この陰イオンの存在を証明することで、新たな酸が生じたこと(体液を酸性に傾ける状況=代謝性アシドーシスの存在)を見出すことができる。このA‐の存在がアニオンギャップ(Anion Gap:AG)として表現される。AGは通常測定する代表的陽イオン(Na+)濃度と通常測定する代表的陰イオン(Cl‐やHCO3‐)濃度の差で表される。
よって、酸の発生により生じた新たなA‐の存在は、A‐が代表的陰イオン(Cl‐やHCO3‐)でない限り、AGの上昇という形で表現される。例えば、高度腎不全などでは硫酸イオンやリン酸イオンがA‐となるし、乳酸アシドーシスでは乳酸イオンが、ケトアシドーシスではアセト酢酸イオンやβヒドロキシ酪酸イオンがA‐となり、血中に代謝・排泄されずに存在すれば、AGの上昇を来すことになる。